Muchos científicos han contribuido a la comprensión del átomo. Desde Dalton hasta la actualidad, las ideas han evolucionado y el átomo se ha hecho más complicado. Cada nuevo modelo es capaz de explicar fenómenos que con el modelo anterior resultaban incomprensibles. En CurioSfera-Ciencia.com, te explicamos qué son los átomos y sus características.
Ver las propiedades de las sustancias
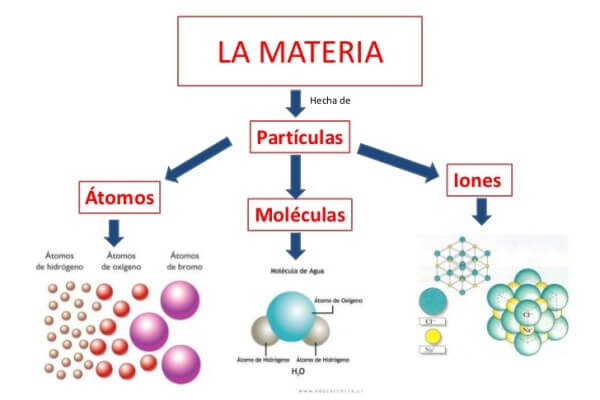
Que son los átomos
El átomo es la porción más pequeña de un elemento. La idea de la materia formada de átomos fue imaginada por primera vez por un griego, Demócrito, 400 años antes de Cristo, a fin de dar respuesta a una pregunta parecida a la que podríamos hacer nosotros cuando observamos una gota de mercurio sobre una mesa:
¿Qué pasaría si fuéramos dividiendo la gota en trozos cada vez más pequeños? ¿La podríamos ir dividiendo hasta el infinito? ¿O, por el contrario, obtendríamos finalmente la partícula de mercurio lo más pequeña posible? Demócrito creyó que esta pequeña partícula de mercurio, o de cualquier sustancia, debía existir, y la llamó con una palabra griega, átomo, que significa «sin división» o «indivisible».
Teoría atómica de Dalton
Un científico inglés, John Dalton, recogió, en 1808, las ideas de Demócrito y las mejoró, para explicar numerosas observaciones que él y otros científicos habían hecho. Estas ideas formaron lo que llamamos teoría atómica. Puntos principales de su teoría atómica:
- Todo elemento o sustancia simple está formado por átomos. Los átomos son indivisibles, y no pueden ser creados ni destruidos.
- Los átomos de un mismo elemento son idénticos, tienen el mismo peso y las mismas propiedades. En cambio los átomos de elementos diferentes son diferentes.
- Los átomos se combinan entre sí y forman moléculas.
Qué tamaño tienen los átomos
Los átomos son muy pequeños. Su diámetro es de 0,00000001 cm, es decir, 10-8 cm. Se calcula que si una manzana aumentara de tamaño hasta hacerse tan grande como la Tierra, sus átomos no serían más grandes que una pelota de ping-pong.
La materia está formada de átomos
Toda la materia está formada por átomos. Este concepto puede resultar un poco complejo de comprender. Por ello, vamos a hacerlo con un ejemplo muy sencillo que puedes probar en tu casa:
Si ponemos en un vaso de agua un pequeño cristal violeta de permanganato de potasio, observaremos como el agua, poco a poco, se va volviendo de color violeta. ¿Qué ha pasado? Podemos imaginar varias respuestas diferentes. Por ejemplo, podemos suponer que el cristal se ha estirado como una goma elástica. O que ha crecido rápidamente, de forma similar al crecimiento de una planta. O que se ha deshecho en pedazos o partículas muy pequeñas que se han esparcido por el vaso con un movimiento incesante.
Elegir la respuesta más adecuada no es muy fácil. Los científicos han tenido que hacer muchas experiencias para llegar a la conclusión de que las sustancias están formadas de pequeñas partículas; estas partículas las llamamos átomos.
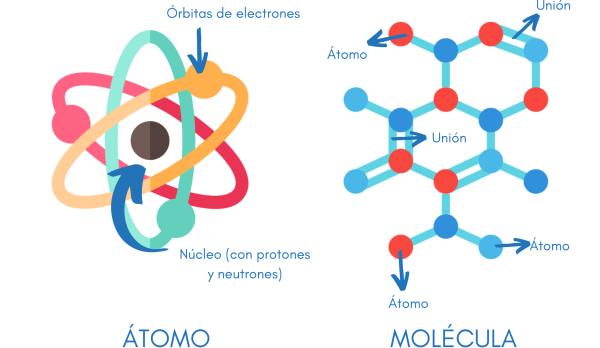
¿Cómo es un átomo por dentro?
La siguiente pregunta lógica es, ¿cómo es el interior de un átomo? Cuando Dalton propuso su teoría, imaginó el átomo como una bola compacta. Pero, más adelante, el descubrimiento de los rayos X y otras experiencias sugirieron que en el interior debía haber subpartículas cargadas eléctricamente. ¿Cómo estarían situadas estas partículas? Se formularon diferentes respuestas:
- El átomo podía ser como una bola de nata con fresas, donde las fresas serían las partículas eléctricas insertadas dentro de la masa del átomo.
- Se pensó también que las partículas estarían situadas en capas diferentes, como la almendra y el azúcar de un confite.
- Y también que el átomo podía ser vacío, como una pelota de ping-pong, y que las partículas podían ser como granitos de sal en el interior.
Cuando se comprobaba que una teoría no explicaba bastante bien el comportamiento del átomo, los científicos la rechazaban. Hoy día, la idea que tenemos del interior del átomo es el resultado de muchas pruebas y experiencias.
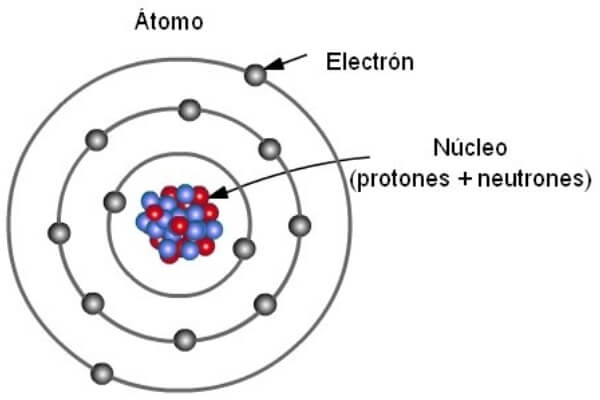
¿De qué están formados los átomos?
Los átomos están formados por tres elementos: los protones, los neutrones y os electrones:
Protones y neutrones
Actualmente creemos que la mayor parte de la masa de un átomo está concentrada en el centro, es decir, en la parte del átomo que llamamos núcleo. Este núcleo está formado por dos clases de partículas: los protones, que tienen una carga eléctrica positiva, y los neutrones, que no están cargados eléctricamente.
Electrones
Alrededor del núcleo se mueven los electrones, que son partículas cargadas negativamente. Su masa unas 2.000 veces más pequeña que la del protón. Se mueven de manera incesante en torno al núcleo, pero no pasan siempre por los mismos lugares, aunque hay algunas zonas donde la probabilidad de encontrarlos es mayor. Por esta razón podemos decir que los átomos no tienen una forma definida.
El átomo está prácticamente vacío
Como el diámetro del átomo es 100.000 veces mayor que el núcleo, podemos considerar su interior como un gran espacio vacío. Si imaginamos que un átomo crece hasta alcanzar el tamaño de un campo de fútbol, el núcleo será grande como una cabeza de alfiler y los electrones serán más pequeños que partículas de polvo. Las primeras partículas atómicas que se descubrieron fueron el electrón, el protón y el neutrón. Pero actualmente se conocen más de un centenar de partículas diferentes más.
Número atómico y número másico
Cómo debes imaginar, existe un método para poder escribir las características de un átomo de forma rápida y eficaz. Estamos hablando del número atómico y el número másico:
Qué es el número atómico
Todos los átomos son neutros: no tienen carga positiva ni carga negativa. El número de cargas positivas que contiene el núcleo es el mismo que el de las cargas negativas que se mueven alrededor. Dicho de otro modo, el número de protones es igual al número de electrones.

Este número, que es el mismo para todos los átomos de un mismo elemento, la llamamos número atómico del elemento. Por ejemplo, todos los átomos de aluminio tienen 13 protones y 13 electrones. Por tanto, el número atómico del aluminio es 13.
Qué es el número másico
Como la masa de los electrones es casi nula, la masa de un átomo depende sobre todo del número de protones y de neutrones que formen el núcleo.
Con el fin de comparar las masas de átomos diferentes utilizamos una unidad que llamamos unidad de masa atómica (u). Las masas del protón y del neutrón son iguales a 1 u. El número másico de un átomo es igual a la suma del número de protones y el número de neutrones. Por ejemplo, el número másico del átomo de aluminio es 27, porque tiene 13 protones y 14 neutrones.
¿Puede haber átomos diferentes de un mismo elemento?
El número de neutrones del átomo de un elemento puede variar. Por ejemplo, un átomo de hidrógeno puede no tener ninguno, o tener uno o dos. En los tres casos se trata de átomos de hidrógeno, para que todos ellos tienen sólo un protón y un electrón. Son isótopos del hidrógeno.
Los isótopos de un elemento tienen todos el mismo número de protones y de electrones, pero el número de neutrones es diferente. Por lo tanto, tienen el mismo número atómico, pero diferente número másico.
Si observamos la lista de las masas atómicas de la tabla periódica, comprobaremos que muchos valores no son números enteros. Esto es así debido a que la masa que indica la tabla es el valor medio de las masas de los diferentes isótopos de un mismo elemento que hay en la naturaleza.
Por ejemplo, si la tabla periódica indica que la masa atómica del hidrógeno es 1,01, significa que la mayoría de átomos de hidrógeno tienen sólo un protón en el núcleo, y que hay muy pocos isótopos de número másico 2 o 3 (es decir, con uno o dos neutrones en el núcleo).
En cambio, en el caso del cloro la masa atómica que indica la tabla es de 35,45. Esto significa que la proporción de isótopos diferentes al del átomo 35 es mucho mayor.
Qué son los átomos resumen
- El átomo es la porción más pequeña de un elemento.
- Los átomos son muy pequeños. Tienen un diámetro de 10-8
- El átomo está formado por diferentes partículas. Las más importantes son las siguientes:
- Los protones, que tienen 1 u de masa y carga eléctrica positiva.
- Los neutrones, que tienen 1 u de masa y no tienen carga eléctrica.
- Los electrones, que tienen una masa casi nula, y prácticamente desechable, y carga eléctrica negativa.
- Los protones y los neutrones están situados en el núcleo. Los electrones giran en grupo alrededor del núcleo.
- El número atómico es el número de protones que tiene un átomo.
- El número másico es el número de protones más el de neutrones.
- Los átomos de un mismo elemento que tienen diferente número de neutrones los llamamos isótopos.
Otros artículos interesantes
¿Qué es la antimateria? ¿Qué es el metano? ¿Qué son los criptatos? Qué es un desmultiplicador
¿Quieres saber más sobre ciencia?
Desde CurioSfera-Ciencia.com, esperamos que este artículo científico titulado Qué son los átomos y sus características, te haya sido de utilidad. Para leer más información similar, puedes visitar la categoría de ciencia. Y recuerda, si te ha gustado, puedes dejarnos un comentario.
